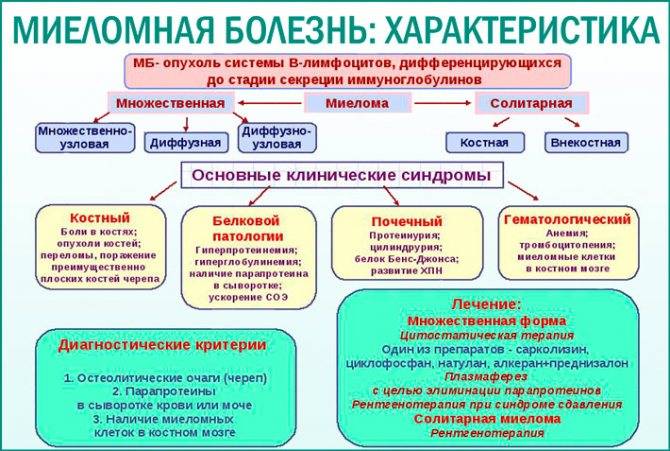
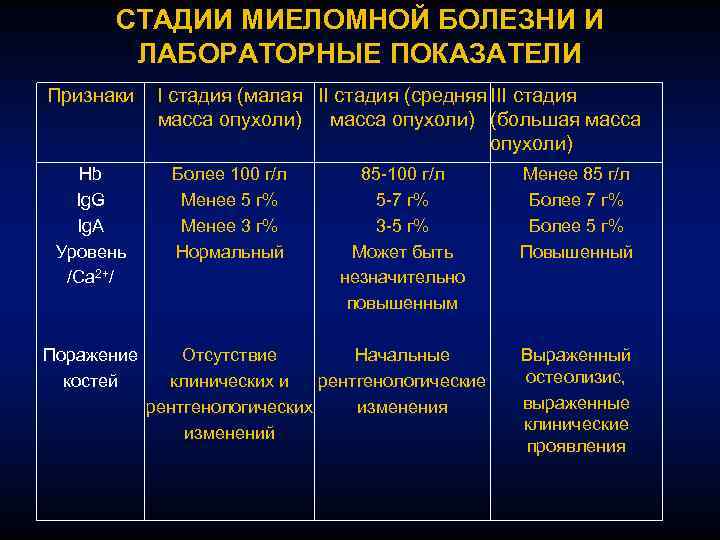
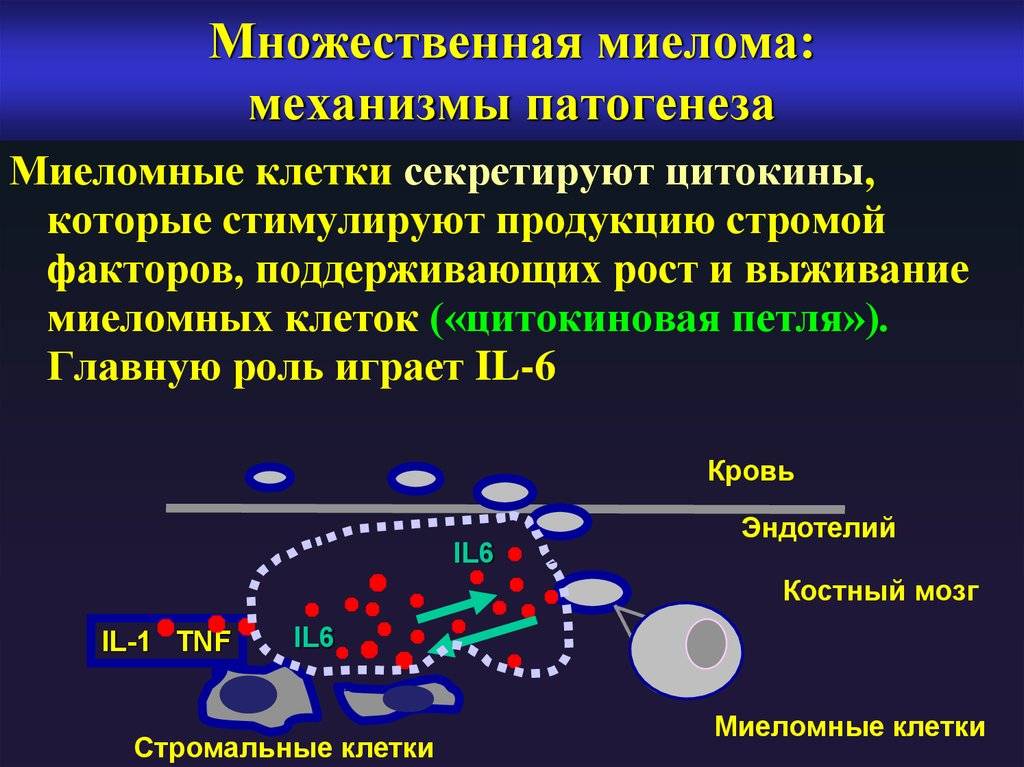
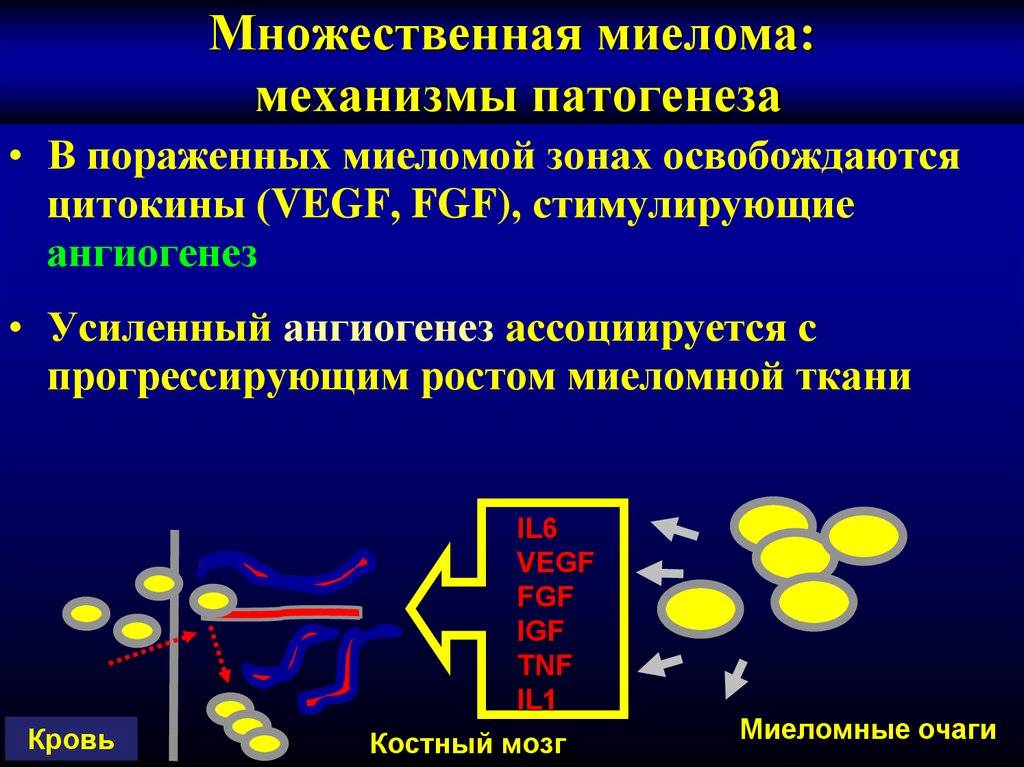
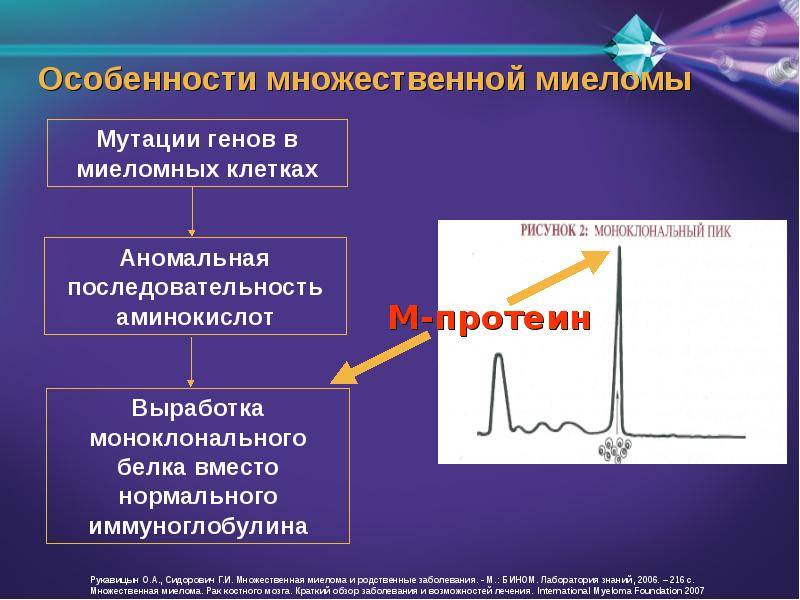
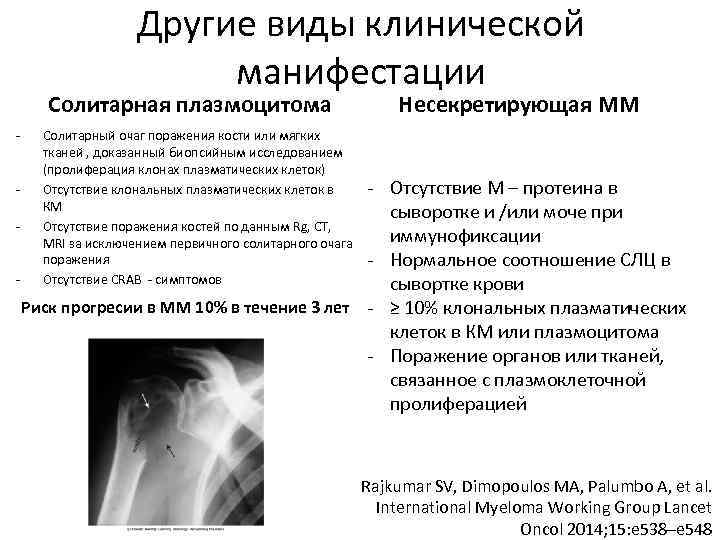
Прогнозировование и факторы риска при миеломе
«Международная система прогнозирования» (ISS. 2005) была разработана на основании данных естественного исхода заболевания значительной клинической группы больных и основана на исследовании бета-2 микроглобулина в динамике. Бета-2 микроглобулин повышен у 75% больных миеломной болезнью.
Выделено три уровня этого онкомаркера, которые связаны с длительной выживаемостью пациентов. Это позволяет определить несколько стадий заболевния.
- бета-2-микроглобулин менее 3,5 мг/л и альбумин более 35 г/л, средняя выживаемость 62 месяца,
- промежуточная между 1 и 3 стадиями, средняя выживаемость 44 месяца.
- бета 2-микроглобулин более 5.5 мг/л, средняя выживаемость 29 мес.
Однако, в настоящее время использование новых препаратов значительно изменило прогноз естественного течения заболевания. Тем не менее, международная система была протестирована для новейшей терапии и подтвердила свою надежность. Так, 5-летняя выживаемость больных в стадии I, II и III составила 66%, 45% и 18% соответственно.
В Международной системе не оказалось места для таких ценных прогностических показателей как число тромбоцитов, уровень лактатдегидрогеназы и свободных легких цепей в крови.
Число тромбоцитов в крови коррелирует с вытеснением костного мозга и имеет предсказательное значение выше, чем у альбумина. Содержание лактатдегидрогеназы (ЛДГ) коррелирует с общей массой миеломных клеток, недостаточным ответом на терапию и укорочением выживаемости. У больных с уровнем свободных легких цепей в крови свыше 4,75 г/л чаще выявляется почечная недостаточность, высокой процент миеломных клеток в пунктате костного мозга, высокие значения бета-2-микроглобулина и лактатдегдрогеназы, чаще обнаруживается болезнь отложения легких цепей и стадия III по Международной системе. Однако представленных доказательств оказалось недостаточно, чтобы включить эти три критерия в Международную систему. Но они были представлены в системе Дьюри-Саймона (1975), значение которой не оспаривается до сих пор.
Повышенный уровень сывороточного бета 2-микроглобулина, повышенный уровень лактатдегидрогеназы и низкий уровень сывороточного альбумина относятся к неблагоприятным признакам прогноза при миеломной болезни. Хотя уровень бета-2- микроглобулина увеличивается при почечной недостаточности, существует значительная корреляция между объемом опухолевой ткани и концентрацией этого биомаркера в крови. Исключение составляют лишь случаи, когда миеломная болезнь развивается уже на фоне имеющейся почечной недостаточности.
Перспективным методом оценки прогноза заболевания является генетическое исследование опухоль-ассоциированных генов. Цитогенетическое выявление транслокаций в отличие от трисомии относится к неблагоприятным прогностическим признакам. Метод флюоресцентной гибридизации in situ (FISH) позволил упростить выявление хромосомных аберраций в миеломных клетках, что предлагается исследователями клинико Мэйо (США) использовать для выбора индивидуальной лечебной тактики, исходя из прогноза для больного на основании учета выявленных аберраций. Генетические исследования хромосомных аномалий и мутаций при миеломе являются перспективными методами для лабораторной оценке прогноза и устойчивости к терапии при миеломе. Однако для их оценки требуются большие сроки и число пролеченных больных, чтобы определить способность новых средств терапии преодолеть цитогенетические показатели высокого риска при миеломной болезни.
Лечение болезни
Лечит болезнь гематолог в условиях стационара, и поддерживая контроль состояния пациента. Миелома и болезнь Вальденстрема считаются родственными, но с наличием серьёзных различий. Обе патологии успешно лечатся в Германии, Израиле и в России лучшими гематологическими центрами. Эффективным методом терапии патологии является пересадка костного мозга – проводится с использованием донорских стволовых клеток.
За опухолью на начальном этапе врачи предпочитают просто наблюдать, не используя терапевтические процедуры. Пациент регулярно сдает кровь и мочу на исследование состава на предмет патологических изменений.
При появлении выраженных симптомов болезни применяется химиотерапия с использованием лекарственных препаратов из группы цитостатиков. Процедура может быть стандартной или высокодозной. Часто используются следующие препараты – Мелферан, Циклофосфан, Карфилзомиб, Сарколизин, Бортезомиб и Леналидомид. Для больных в возрасте 65 лет применяется лекарство – Алкеран, Преднизолон, Циклофосфан или Винкристин. Костная миелома эффективно лечится с использованием бисфосфонатов – Аредией, Бондронатом и Бонефосом.
Облучение гамма-лучами рекомендуется при наличии болевых синдромов или диагнозе костной патологии с присутствием серьезных очагов разрушений, в курсе терапии солитарной миеломы и во время последней стадии, в качестве паллиативного метода. Дополнительно назначают Дексаметазон.
Иммунотерапия заключается в приеме альфа2-интерферона большими дозами на протяжении нескольких лет – это позволяет предотвратить нежелательные последствия и рецидив. При диагнозе почечной недостаточности применяются диуретики, специальное питание и плазмаферез (переливание крови). Процедура гемодиализа – очищенная лимфома обогащается необходимыми микроэлементами. Антибиотики требуются при наличии воспалительных процессов.
Рекомендуется выполнять все клинические рекомендации лечащего врача – это позволит предотвратить тяжелые осложнения и остановить онкологический процесс.
Миелома (миеломная болезнь, множественная миелома) – лечение
Химиотерапия
Монохимиотерапия
- Мелфалан – принимать по 0,5 мг/кг 4 дня через каждые 4 недели, и вводить внутривенно по 16 – 20 мг на 1 м2 площади тела также по 4 дня через каждые 2 недели.
- Циклофосфамид – принимать по 50 – 200 мг один раз в день в течение 2 – 3 недель или вводить внутримышечно по 150 – 200 мг в сутки через каждые 2 – 3 дня в течение 3 – 4 недель. Можно вводить раствор внутривенно по 600 мг на 1 м2 площади тела один раз в две недели. Всего следует сделать 3 внутривенные инъекции.
- Леналидомид – принимать по 25 мг каждый день в одно и то же время в течение 3 недель. Затем делают перерыв на неделю после чего возобновляют терапию, постепенно снижая дозировку до 20, 15 и 5 мг. Леналидомид следует сочетать с Дексаметазоном, который принимается по 40 мг 1 раз в сутки.
Полихимиотерапия
- Схема МР – Мелфалан принимать в таблетках по 9 мг/м2 и Преднизолон по 100 – 200 мг в течение 1 – 4 дней.
- Схема М2 – в 1 день внутривенно вводить три препарата: Винкристин по 0,03 мг/кг, Циклофосфамид по 10 мг/кг и BCNU по 0,5 мг/кг. С 1 по 7 дни вводить внутривенно Мелфалан по 0,25 мг/кг и принимать внутрь по 1 мг/кг Преднизолона.
- Схема VAD – в 1 – 4 дни включительно внутривенно вводить два препарата: Винкристин по 0,4 мг/м2 и Доксирубицин по 9 мг/м2. Одновременно с Винкристином и Доксирубицином следует принимать по 40 мг Дексаметазона один раз в день. Затем с 9 по 12 и с 17 по 20 дни принимают только по 40 мг Дексаметазона в таблетках по одному разу в сутки.
- Схема VBMCP (мегадозная химиотерапия для людей моложе 50 лет) – в 1 день внутривенно вводят три препарата: Кармустин по 100-200 мг/м2, Винкристин по 1,4 мг/м2 и Циклофосфамид по 400 мг/м2. С 1 по 7 дни включительно принимают внутрь в таблетках два препарата: Мелфалан по 8 мг/м2 1 раз в сутки и Преднизолон по 40 мг/м2 1 раз в день. Через 6 недель повторно в той же дозе вводят Кармустин.
трансплантациюстволовых клетокинтерферонаАльтевирПодробнее о химиотерапии
Что такое лечение множественной миеломы?
Существует не известное лечение, которое лечит множественную миелому. Тем не менее, существуют методы, позволяющие уменьшить возникновение и тяжесть симптомов и продлить жизнь. Терапия определяется на основании состояния пациента и группы по борьбе с раком, сделанной с использованием пациента. Команда, вероятно, будет включать как медицинского специалиста в лечении миеломы, так и врача-онколога, а также лучевого онколога и других консультантов. Онкологические медицинские сестры и другие сотрудники, вероятно, будут важными членами группы лечения.
Варианты лечения (лечения) часто включают комбинации лекарств, некоторые из которых назначаются в виде таблеток и других путем внутривенной инъекции. К ним относятся препараты, которые влияют или модулируют иммунную систему, стероиды и некоторые пероральные или инъекционные химиотерапевтические препараты. Они обычно используются в комбинациях. Может быть роль для высокодозной химиотерапии с последующим введением стволовых клеток костного мозга, называемых трансплантацией стволовых клеток или аутотрансплантацией. При определении того, следует ли делать такую трансплантацию, вступают в силу многочисленные факторы. Дополнительная информация может быть получена из Руководства по национальной комплексной онкологической сети (NCCN.org), которые обновляются не реже одного раза в год. Другие медицинские процедуры могут включать стероиды, бисфосфонатную терапию, переливание крови или тромбоцитов, аутотрансплантацию и / или плазмаферез и другую комбинированную терапию в зависимости от стадии заболевания отдельного пациента. Кроме того, исследователи используют метаанализ (систематическое объединение данных из отдельных исследований для разработки более значимого заключения) нескольких исследований, чтобы помочь определить лучшие протоколы лечения болезни.
Болезненные области повреждения кости можно лечить лучевой терапией. Во многих случаях сломанные кости могут быть хирургически восстановлены.
Существует много лекарств, используемых для лечения множественной миеломы. Следующие препараты часто используются в комбинации с дексаметазоном, иногда перорально или по IV, в зависимости от индивидуального состояния болезни пациента:
- Дексаметазон (Декадрон) — модуляция иммунных клеток
- Бортезомиб (Velcade) — ингибитор протеазы
- Леналидомид (Revlimid) — модуляция иммунных клеток
- Памидроновая кислота (Aredia) — ингибирует резорбцию кости
- Золедроновая кислота (Zometa) — ингибирует резорбцию кости
- Мелфалан (Alkeran) — алкилирующий агент, который токсичен для клеток миеломы
- Carfilzomib (Kyprolis) — ингибитор протеазы, который одобрен FDA обычно для пациентов, у которых не было предыдущего лечения
- Daratumumab (Darzalex) — моноклональное антитело, которое может повредить или убить несколько клеток миеломы (и других), которые имеют белок CD38 на их поверхности
- Elotuzumab (Empliciti) — соединение, которое активирует естественные клетки-убийцы тела для уничтожения нескольких клеток миеломы, обычно в сочетании с Revlimid и Decadron
Есть по меньшей мере семь или восемь других препаратов, которые иногда используются отдельно или в сочетании с переливанием, хотя эффекты переливания являются временными. Исследования продолжаются, и новые препараты и комбинации лекарств исследуются и используются для лечения с некоторой частотой. Большинство специалистов здравоохранения, специализирующихся на лечении рака, знают о новейших методах лечения множественной миеломы (например, Procrit, Revlimid, Kyprolis). Кроме того, ваш врач может устранить побочные эффекты (например, тошноту и рвоту с помощью химиотерапии), которые могут возникать при лечении. Одной из целей лечения является выживаемость без прогрессирования; то есть продолжительность времени и после лечения, что пациент живет без ухудшения симптомов. Кроме того, низкодозовая терапия препаратами изучается у пожилых пациентов с множественной миеломой.
Диагностика
Увеличенная СОЭ может длительное время быть единственным признаком болезни.
В общем анализе крови значительно увеличена скорость оседания эритроцитов, снижено содержание лейкоцитов, прежде всего нейтрофилов, повышено количество моноцитов, могут обнаруживаться плазматические клетки. Кроме того, уменьшается содержание гемоглобина и эритроцитов при сохранении нормального цветового показателя (нормохромная анемия). Может снижаться и количество тромбоцитов.
Если в крови обнаруживают плазматические клетки (лимфоциты, производящие иммуноглобулины) – это не является признаком миеломной болезни, они могут обнаруживаться и у здорового человека.
В общем анализе мочи находят белок и цилиндры, при дополнительном исследовании может определяться белок Бенс-Джонса. При развитии осложнений в моче находят кровь (при почечном кровотечении), лейкоциты и бактерии (при инфекции мочевыводящих путей).
Для определения функции почек назначают анализ мочи по Зимницкому, а также определяют суточную потерю белка с мочой.
В биохимическом анализе крови определяются разнообразные нарушения белкового и минерального обмена, а также показатели нарушенной работы почек: повышение содержания общего белка и гамма-глобулинов, кальция, мочевой кислоты, креатинина и мочевины.
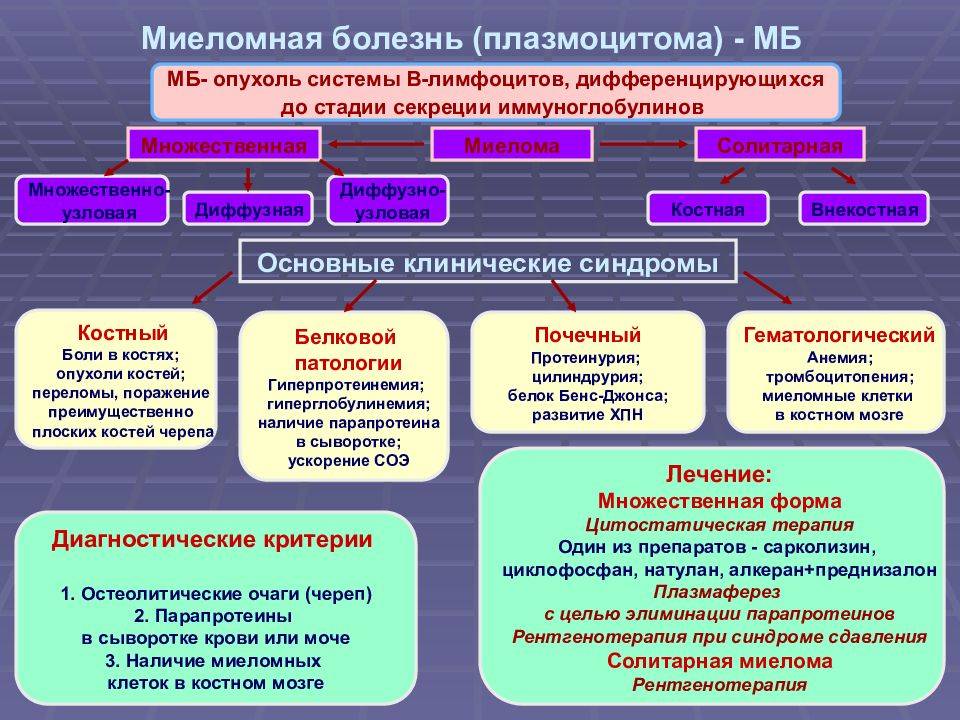
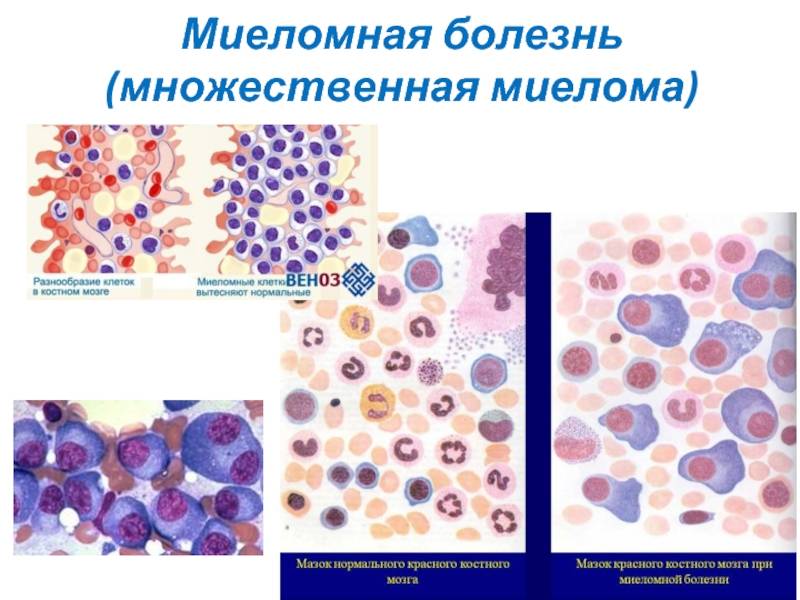
В миелограмме (пунктате костного мозга) находят больше 15% плазматических клеток, могут быть обнаружены измененные миеломные клетки, нормальные клетки кроветворения представлены в меньшем количестве. Костный мозг получают путем стернальной пункции (прокалывания грудины специальной толстой иглой) или трепанобиопсии (взятия столбика, состоящего из кости и костного мозга, из подвздошной кости, с помощью специального трепана).
Диагноз считается достоверным, если у больного обнаружены два следующих признака:
- содержание миелоцитов в костном мозге больше 15%;
- плазмоклеточная инфильтрация в трепанате, полученном при трепанобиопсии.
Если имеется лишь один из перечисленных признаков, для подтверждения диагноза необходимо наличие всех трех из следующих дополнений:
- парапротеин в крови и моче;
- остеолиз или генерализованный остеопороз;
- плазматические клетки в крови.
При пункции костного мозга у 90-96% больных имеется картина избыточного размножение миеломных клеток (миеломноклеточная пролиферация). Однако при очаговом поражении этих изменений может не быть. Поэтому нормальная картина костного мозга не исключает диагноз.
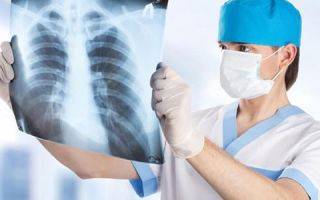
Проводится рентгенологическое исследование черепа, ребер и позвоночника. В этих костях чаще всего выявляются изменения при миеломной болезни. Рентгенологические признаки могут отсутствовать при генерализованном поражении костного мозга. В других случаях определяется остеопороз (снижение минеральной плотности тканей), остеолиз (растворение костной ткани), остеосклероз (утолщение и потеря структуры кости), патологические переломы, а также характерные «штампованные» очаги костной деструкции.
Дополнительно могут быть назначены следующие исследования:
- люмбальная пункция при подозрении на поражение центральной нервной системы;
- ультразвуковое исследование внутренних органов, особенно почек;
- спиральная компьютерная томография, позволяющая найти очаги миеломы;
- магнитно-резонансная томография, при которой формируется подробная трехмерная картина опухоли и окружающих тканей;
- электрокардиография, выявляющая нарушения сердечного ритма при амилоидозе;
- биопсия кожи или слизистой оболочки для обнаружения в них отложений парапротеинов.
При миеломной болезни нельзя использовать йод-содержащий контраст, поскольку он может необратимо повредить почки у таких больных, соединившись в нерастворимый комплекс с парапротеинами.
Дифференциальный диагноз проводят с лимфомой, остеомиелитом, а также с заболеваниями, сопровождающимися остеопорозом:
- старение;
- менопауза;
- болезнь Реклингхаузена;
- метастазирующий рак простаты;
- рак щитовидной железы с метастазами в кости.
Причины миеломной болезни
Болезнь Рустицкого-Калера изучена врачами, однако по поводу причин ее возникновения в медицинских кругах нет единого мнения. Было обнаружено, что в организме больного человека часто присутствуют лимфатические вирусы Т или В типа, а поскольку из В-лимфоцитов образуются плазмоциты, любое нарушение этого процесса приводит к сбою и началу образования патоплазмацитов.
Помимо вирусной версии, имеются доказательства того, что миеломная болезнь может быть спровоцирована и в результате радиоактивного облучения. Врачи изучали людей, пострадавших в Хиросиме и Нагасаки, в зоне взрыва на Чернобыльской АЭС. Было обнаружено, что среди получивших большую дозу облучения высок процент заболевших миеломой и другими заболеваниями, поражающими кровеносную и лимфатическую системы.
Среди негативных факторов, которые повышают риск заболеть миеломной болезнью, врачи называют:
- курение – чем дольше стаж курильщика и больше количество выкуриваемых сигарет, тем выше риск;
- иммунодефицит;
- воздействие на организм токсичных веществ;
- генетическую предрасположенность.
Можно ли вылечиться при миеломе крови?
Прежде всего, пациентов с диагнозом «миелома» заботит вопрос, можно ли вылечиться от этого заболевания или, по крайней мере, добиться стойкой ремиссии. На данный момент миеломная болезнь считается неизлечимой. Большинство терапевтических курсов направлено на достижение максимального противоопухолевого эффекта при минимизации вреда самих лекарственных препаратов на здоровье пациента.
Наиболее эффективным методом лечения считается комбинация интенсивной полихимиотерапии и трансплантации здоровых костномозговых тканей. Операция существенно повышает продолжительность жизни пациента и способна обеспечить стойкую ремиссию. Однако шансы на успешное приживление трансплантата у пожилых пациентов в большинстве случаев слишком низки, чтобы идти на риск вместо использования более щадящего цитостатического курса.
Традиционный и самый популярный метод лечения – химиотерапия. Самой высокой эффективностью обладают высокотоксичные комбинированные схемы с Мелфаланом, Циклофосфамидом, Винкристином и другими цитостатическими препаратами. В ряде случаев более оправдано применение монохимиотерапевтических курсов.
Проведение химиотерапии на ранних стадиях болезни даёт возможность достигнуть ремиссии длительностью от нескольких месяцев до нескольких лет.
При одиночном (солитарном) очаге миеломной болезни практикуют удаление поражённой кости или локальное облучение опухоли и комплексную терапию после операции. Это обеспечивает пациентам продолжительность жизни значительно выше среднего показателя для больных миеломой.
К сожалению, при рецидиве заболевание в большинстве случаев не возвращается в солитарной форме, а превращается во множественный миеломатоз. Это обусловлено тем, что патологические клетки переносятся с током крови в течение всего времени развития опухоли, а не только на последних его стадиях, как при других видах онкологических заболеваний. Поэтому даже при условии полного удаления очага болезни гарантии постоянной ремиссии нет.
С целью раннего диагностирования рецидива необходимо периодически проходить осмотр у онколога и исследовать основные показатели крови (уровень гемоглобина, тромбоцитов и белков, лейкоцитарную формулу, а также состояние костной ткани).
Причины и патогенез миеломной болезни
Причины миеломы неизвестна. Есть ряд факторов, повышающих риск заболеть:
-
Возраст. До 40 лет миеломной болезнью почти не болеют, после 70 лет риск развития заболевания значительно повышен
-
Мужчины болеют чаще женщин
-
У людей с черным цветом кожи риск миеломы в два раза выше, чем у европейцев или азиатов
-
Имеющаяся моноклональная гаммапатия. У 1 из 100 человек гаммапатия трансформируется в множественную миелому
-
Семейная история заболевания миеломой или гаммапатией
-
Патология иммунитета (ВИЧ или применение лекарств, подавляющих иммунитет)
-
Воздействие радиации, пестицидов, удобрений
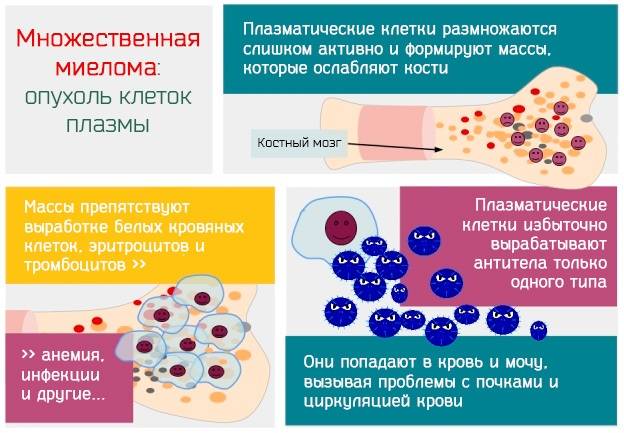
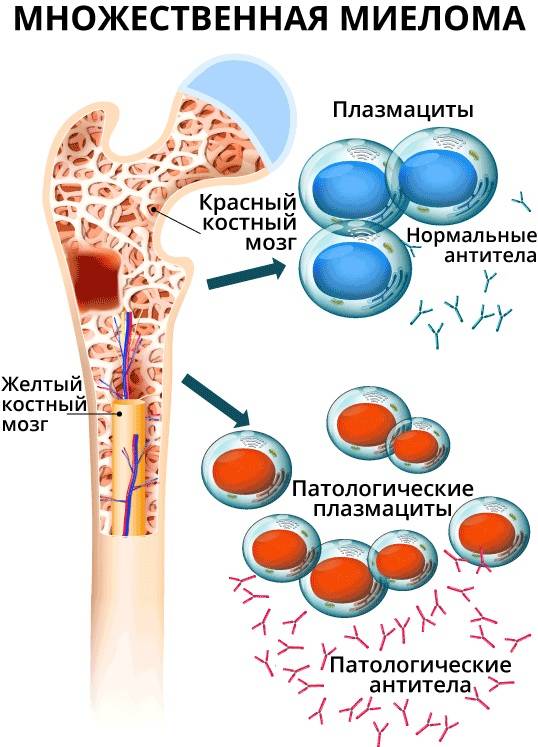
Костный мозг в обычных условиях вырабатывает строго определенное количество В-лимфоцитов и плазматических клеток. При миеломной болезни их выработка выходит из-под контроля, костный мозг заполняется аномальными плазматическими клетками, а образование нормальных лейкоцитов и эритроцитов снижается. При этом вместо антител, полезных в борьбе с инфекциями, такие клетки производят белки, способные повреждать почки.
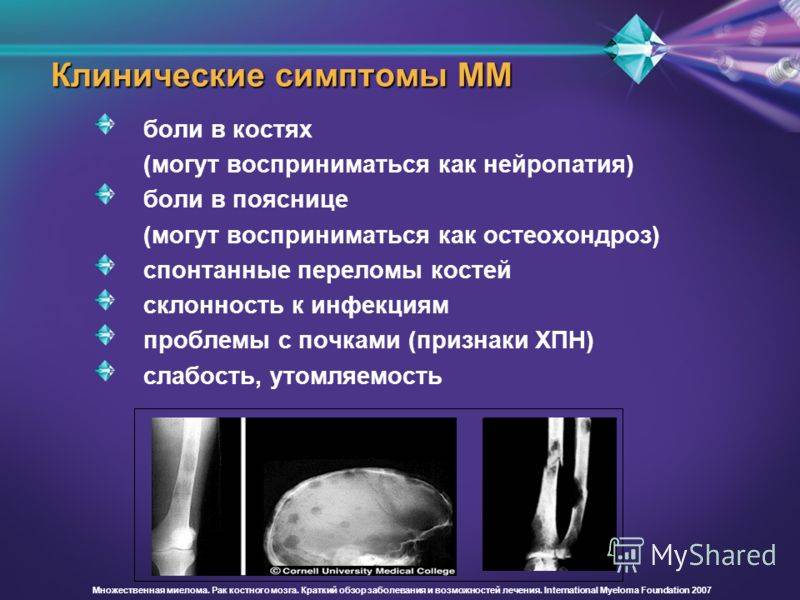
Симптомы множественной миеломы
Миеломная болезнь имеет длительное течение. От первых симптомов заболевания до ярких клинических признаков проходит 10-20 лет.
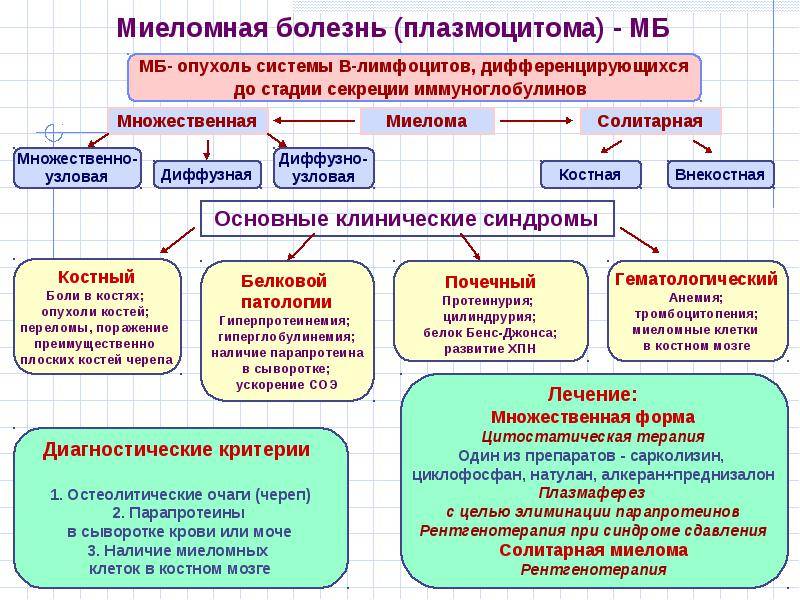
- Костно – мозговой синдром проявляется лизисом костей. В основном поражается позвоночник, плоские кости, проксимальные отделы трубчатых костей. Дистальные отделы поражаются крайне редко. Больные жалуются на боли в костях, частые переломы. При перкуссии боль в конечностях.
- Триада Калера (остеопороз со спонтанными переломами, болью, опухолями) патогномонично для этих больных.
- Характерно нарушение в работе центральной нервной системы вплоть до развития параплегии (полной обездвиженности в конечностях), слабость, утомляемость. Из-за отложения амилоида в костях черепа возможны нарушения в работе черепных нервов. Характерным является поражение периферических нервов конечностей и нарушение чувствительности по типу «перчаток и носок». Отсутствие чувствительности в дистальных отделах конечностей.
- Почечная недостаточность может быть вызвана высоким уровнем белка M в организме.
- Синдром иммуноглобулинопатии. Начинает синтезироваться белок амилоид. В процессе мочеобразования он активно реабсорбируется почками, повреждая их. В моче нарастает протеинурия (белок Бенс-Джонса). Постепенно снижается концентрационная и фильтрационная функция почек, появляются отёки, положительный симптом поколачивания (боли в пояснице при поколачивании кулаком по этой области).
- Синдром иммунодефицита. Нормальный белок начинает заменяться патологическим. Синтез антител и компонентов иммунитета нарушается. В результате постепенно нарастает дефект гуморального иммунитета. Больные становятся незащищенными от бактериальных и вирусных инфекций. Характерно появление оппортунистических инфекций. Любой контакт с инфекционным агентом приводит к развитию заболевания
- Синдром повышенной вязкости: повышенная кровоточивость, синдром Рейно (нарушение микроциркуляции в дистальных сегментах конечностей), кровоизлияния в сетчатку, снижение кровоснабжения в головном мозге, возможно развитие ДВС – синдрома.
- Гиперкальциемия. В результате повышенной активности остеокластов (клеток, которые разрушают кости) в кровь выделяется большое количество кальция. Симптомы гиперкальциемые – тошнота, рвота, судороги. Характерно нарушение сердечной проводимости: увеличивается интервал QRS и Т, снижение АВ-проводимости, вплоть до АВ-блокады. Образование камней в почках. Это связано с отложением кальция, снижается фильтрация и реабсорбция. Почка сморщивается.
- Поражение внутренних органов: спленомегалия, гепатомегалия, язвенное поражение желудка. В различных органах и тканях откладывается амилоид, что приводит к нарушению их работы. Характеры боли в сердце, расширение границ сердечной тупости, глухость тонов. Боли в мышцах могут носить постоянный характер.
- Анемический синдром. Опухолевые клетки со временем вытесняют нормальный росток кроветворения. Снижается количество гемоглобина, эритроцитов. Кожные покровы покрывается кровянистыми пятнами и бледнеет (см. 2 фото выше), возникает постоянное чувство слабости. Волосы и ногти становятся ломкими.
Признаки заболевания
На начальном этапе болезнь развивается скрытно – выраженная клиника отсутствует. При раке клетки постепенно распространяются по организму, поражая внутренние полости плоских костей – зону лопаток, позвонков и черепа, а также трубчатые кости.
В медицинской практике есть примеры диагностирования миелосаркомы – онкологического процесса, формируемого тельцами белого кровотока. При дальнейшем развитии на поверхности костей появляются наросты овальной формы с мягкой эластичной консистенцией, что приводит к разрушению костной структуры.
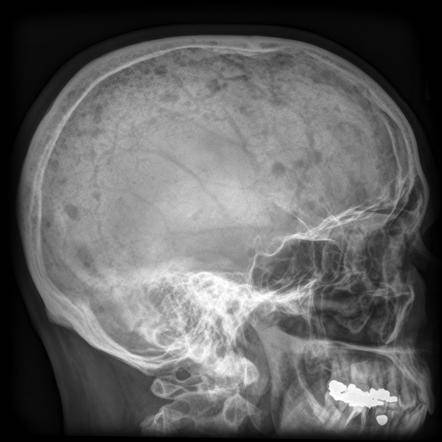 Разрушение костной структуры миеломой
Разрушение костной структуры миеломой
В основном присутствуют следующие симптомы миеломы:
- нарушения в работе органов пищеварения;
- температура тела постоянно меняется – может подняться до термальных показаний и сразу снизиться;
- мышечная слабость на фоне быстрой утомляемости;
- показатели основных элементов крови характеризуют признаки анемии;
- наблюдаются частые болезни инфекционного характера;
- болевые синдромы в области мягких тканей с чувством дискомфорта;
- частый сердечный ритм – 100-120 ударов в минуту;
- в зоне подреберья присутствует чувство тяжести;
- сильные боли в области головы;
- гиперкальциемия позвонка приводит к внутренним изменениям структуры;
- миеломаляция развивается, когда дифференцированная опухоль сдавливает соседние ткани;
- нефропатия развивается при поражении почечных клеток.
При появлении первых симптомов болезни нужно обратиться к врачу и пройти обследование организма, чтобы определить тип патологии. Лечение на начальном этапе формирования гарантирует положительный эффект и быстрое выздоровление.
Общее описание
Причины, способствующие развитию миеломной болезни, на сегодняшний день так и остаются неизвестными. Среди потенциальных рисков, способствующих ее возникновению, выделяют контакт с пестицидами и радиоактивными веществами, с бензолом, а также с определенными разновидностями органических растворов.
В основном проявления миеломы характеризуются множественностью возникновения свойственных ей опухолевых литических образований, сосредотачиваемых в костях, остеопорозом, а также диффузным плазмоцитозом, локализующимся в костном мозге. Циркуляция миеломных белков, продуцируемых плазмотическими клетками в значительном количестве, происходит в плазме, за счет чего становится возможным увеличение ее объема, а также общей вязкости, свойственной впоследствии крови. Происходит взаимодействие миеломных белков и факторов, способствующих свертыванию крови, за счет чего ими обволакиваются тромбоциты. Это оказывает соответствующее воздействие на функцию последних, усиливая, тем самым, их кровоточивость.
Плазмотические клетки, помимо миеломных белков, также обладают способностью к производству различного типа цитотоксических факторов, к примеру, тех факторов, которые могут активировать функцию остеокластов. Уже за счет остеокластов обуславливается резорбция костной ткани, что проявляется для больного в болях в костях и патологических переломах. Помимо этого также образуется гиперкальциемия.
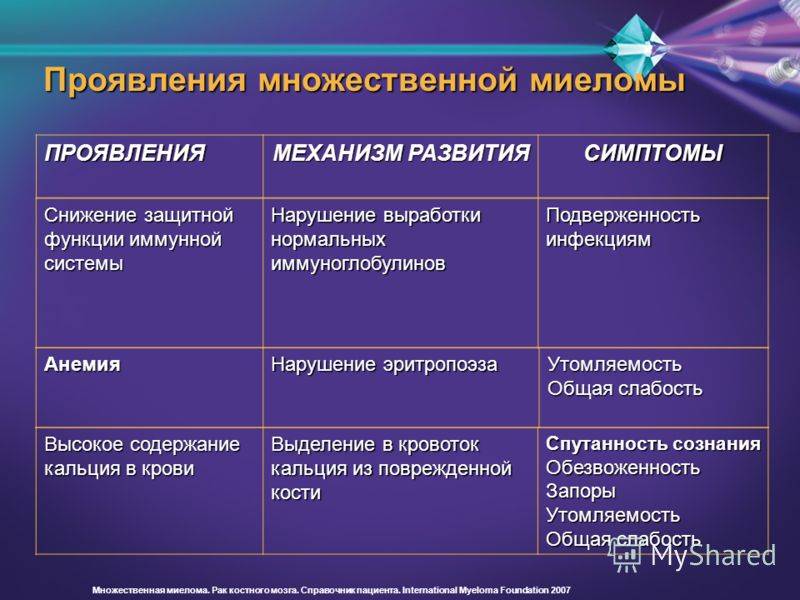
Вследствие происходящей в костном мозге инфильтрации возникает анемия, причем проявляться она может в самых различных степенях тяжести. Основные симптомы анемии: выраженная слабость, повышенная утомляемость, пониженное давление, дрожание рук, головокружения, достигающие в некоторых случаях предобморочного состояния, и, как следствие, обмороков. Также следствием инфильтрации выступает лейкопения или/тромбоцитопения. В результате уменьшения общего количества лейкоцитов, а также нарушений в синтезе иммуноглобулинов возможным становится проявление в виде депрессии гуморального иммунитета, а также иммунитета клеточного (в меньшей степени). Это обстоятельство определяет усиление чувствительности больных по отношению к ряду инфекций (в основном – бактериальных).
Приложение А2. Методология разработки клинических рекомендаций
-
Гематологи
-
Онкологи
Методология сбора доказательств
Поиск публикаций в специализированных периодических печатных изданиях с импакт-фактором {amp}gt; 0.3, поиск в электронных базах данных.
– Обзоры опубликованных мета-анализов;
– Систематические обзоры с таблицами доказательств.
– Консенсус экспертов;
– Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл.П1).
Таблица П1. Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств.
|
Уровень доказательности |
Тип доказательности |
|
1 |
Доказательства получены в результате метаанализа большого числа хорошо спланированных рандомизированных исследований. Рандомизированные исследования с низким уровнем ложнопозитивных и ложнонегативных ошибок |
|
2 |
Доказательства основаны на результатах не менее одного хорошо спланированного рандомизированного исследования. Рандомизированные исследования с высоким уровнем ложнопозитивных и ложнонегативных ошибок. |
|
3 |
Доказательства основаны на результатах хорошо спланированных нерандомизированных исследований. Контролируемые исследования с одной группой больных, исследования с группой исторического контроля и т.д. |
|
4 |
Доказательства получены в результатенерандомизированных исследований. Непрямые сравнительные, описательно корреляционные исследования и исследования клинических случаев |
|
5 |
Доказательства основаны на клинических случаях и примерах |
Таблица П2. Уровни убедительности рекомендаций с указанием использованной классификации уровней убедительности рекомендаций.
|
А |
Высокая достоверность |
Основана на заключениях систематических обзоров. Систематический обзор получают путем системного поиска данных из всех опубликованных клинических испытаний, критической оценки их качества и обобщения результатов методом мета-анализа. |
|
В |
Умеренная достоверность |
Основана на результатах по меньшей мере нескольких независимых рандомизированных контролируемых клинических испытаний |
|
С |
Ограниченная достоверность |
Основана на результатах по меньшей мере одного клинического испытания, не удовлетворяющего критериям качества, например, без рандомизации. |
|
D |
Неопределенная достоверность |
Утверждение основано на мнении экспертов (консенсус экспертов), клинические исследования отсутствуют |
Индикаторы доброкачественной клинической практики (Good Practice Points – GPPs): Доброкачественная практика рекомендаций основывается на квалификации и клиническом опыте авторского коллектива.
– Внешняя экспертная оценка;
– Внутренняя экспертная оценка.
Настоящие рекомендации подготовлены экспертами в области гематологии и онкологии, неоднократно обсуждались на совещаниях экспертных профильных комиссий, были рецензированы независимыми экспертами (в том числе зарубежными), одобрены ведущими специалистами профильных Федеральных центров РФ и практическими врачами.
Данное заболевание очень трудно поддается лечению, для борьбы с недугом следует применять только современные медицинские методики. Никакие «народные» средства не в состоянии остановить злокачественный процесс и то, что в борьбе с миеломой помогает сабельник как средство против рака – настоящее заблуждение.
Непременно следует исключить влияние опасных факторов, которые могут привести к заболеванию.

Химиотерапевтическое лечение является максимально действенным способом терапии
Всем пациентам показано специальное питание при миеломе, оно заключается в низкобелковой диете (не более 40 грамм в сутки), в ограничении употребления яиц, мяса, фасоли.
Симптомы миеломной болезни
Симптомы:
- Боли в костях. Под воздействием миеломных клеток в кости образуются полости. Костная ткань богата болевыми рецепторами, при их раздражении развивается ноющая боль. Она становится сильной и острой при повреждении надкостницы.
- Боли в сердце, суставах, мышечных сухожильях связаны с отложением в них патологических белков. Эти вещества нарушают функционирование органов и раздражают чувствительные рецепторы.
- Патологические переломы. Под воздействием злокачественных клеток в кости образуются пустоты. Развивается остеопороз, кость становится хрупкой и ломается даже при незначительной нагрузке. Чаще всего происходят переломы бедренных костей, ребер и позвонков.
- Снижение иммунитета. Нарушается функция костного мозга: он вырабатывает недостаточно лейкоцитов, что приводит к угнетению защитных сил организма. Количество нормальных иммуноглобулинов в крови уменьшается. Часто возникают бактериальные инфекции: отит, ангина, бронхит. Болезни затяжные и плохо поддаются лечению.
- Гиперкальциемия. Из разрушенной костной ткани большое количество кальция попадает в кровь. Это сопровождается запорами, болью в животе, тошнотой, выделением большого количества мочи, эмоциональными расстройствами, слабостью, заторможенностью.
- Нарушение функции почек – миеломная нефропатия вызвана тем, что кальций откладывается в почечных протоках в виде камней. Также почки страдают от нарушения белкового обмена. Парапротеины (белки, вырабатываемые раковыми клетками) поступают через почечный фильтр, и откладывается в канальцах нефронов. При этом почка сморщивается (нефросклероз). Кроме того нарушается отток мочи из почек. Жидкость застаивается в почечных чашечках и лоханках, при этом атрофируется паренхима органа. При миеломной нефропатии отеки отсутствуют, артериальное давление не повышено.
- Анемия, преимущественно нормохромная – цветовой показатель (соотношение гемоглобина к количеству эритроцитов) остается в норме 0,8 -1,05. При повреждении костного мозга снижается выработка эритроцитов. При этом пропорционально уменьшается концентрация гемоглобина в крови. Поскольку гемоглобин отвечает за транспортировку кислорода, то при анемии клетки ощущают кислородное голодание. Это проявляется быстрой утомляемостью, снижением концентрации внимания. При нагрузке возникает одышка, сердцебиение, головная боль, бледность кожи.
- Нарушения свертываемости крови. Повышается вязкость плазмы. Это приводит к спонтанному склеиванию эритроцитов в виде монетных столбиков, что может вызвать образование тромбов. Снижение уровня тромбоцитов (тромбоцитопения) приводит к спонтанным кровотечениям: носовым и десенным. Если повреждаются мелкие капилляры, то кровь выходит под кожу – образуются синяки и кровоподтеки.